Jednostka Badawcza DPL – Cytotoksyczność – Metoda bezpośredniego kontaktu wg normy PN-EN ISO 10993-5
 Metoda bezpośredniego kontaktu wg normy PN-EN ISO 10993, część 5 jest jedną z metod badawczych cytotoksyczności in vitro poprzez bezpośredni kontakt badanego materiału z hodowlą komórkową. Procedura ta jest powszechnie wykorzystywana do oceny biozgodności biomateriałów/ wyrobów medycznych, i stanowi jakościową metodę określania cytotoksyczności.
Metoda bezpośredniego kontaktu wg normy PN-EN ISO 10993, część 5 jest jedną z metod badawczych cytotoksyczności in vitro poprzez bezpośredni kontakt badanego materiału z hodowlą komórkową. Procedura ta jest powszechnie wykorzystywana do oceny biozgodności biomateriałów/ wyrobów medycznych, i stanowi jakościową metodę określania cytotoksyczności.
Badania in vitro można uznać za pierwszy krok w określaniu biozgodności. Niewątpliwym atutem są niskie koszty przeprowadzania tego typu badań, a otrzymywane wyniki umożliwiają analizę wstępnej odpowiedzi komórek na materiał badany w krótkim czasie. Tymczasem, brak negatywnej reakcji komórkowej w badaniu cytotoksyczności umożliwia rozpoczęcie fazy badań in vivo, w tym badania toksyczności ostrej, podostrej, podprzewlekłej i przewlekłej, działania drażniącego i działania uczulającego, czy implantacji w tkankach.
Procedurę badania cytotoksyczności in vitro, zgodnie z normą z grupy PN-EN ISO 10993-5 „Badania cytotoksyczności in vitro”, przeprowadza się w ramach infrastruktury Laboratorium Komórkowego, wchodzącego w infrastrukturę Laboratorium Wielospecjalistycznego Śląskiego Parku Technologii Medycznych Kardio-Med Silesia. Metoda badawcza polega na umieszczeniu materiału badanego (fragmentu biomateriału lub wyrobu medycznego) bezpośrednio na warstwie komórek, pochodzących z linii komórkowej L-929, i ich ekspozycji na materiał badany przez czas min. 24h, w temperaturze 37 ± 1°C oraz w warunkach 5 ± 1% atmosfery CO2. Na rysunku nr 1 zaprezentowano poglądowo pojedynczy dołek płytki hodowlanej, podczas badania cytotoksyczności in vitro metodą bezpośredniego kontaktu.
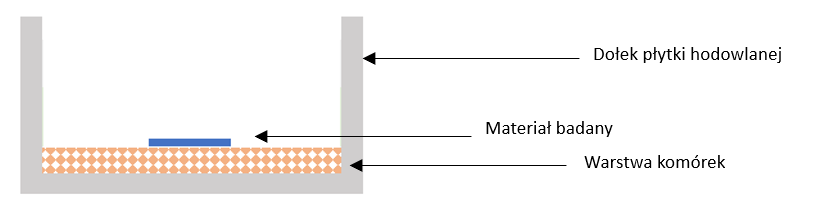
Rys. nr 1. Wizualizacja dołka płytki hodowlanej w badaniu cytotoksyczności metodą bezpośredniego kontaktu, zgodnie z normą PN-EN ISO 10993-5 „Biologiczna ocena wyrobów medycznych – część 5: Badania cytotoksyczności in vitro”.
 Odczyt wpływu cytotoksycznego materiału badanego na komórki wykonywany jest z wykorzystaniem mikroskopu fluorescencyjnego, dzięki któremu możliwym jest zobrazowanie stanu komórek bezpośrednio przed i po usunięciu badanego materiału, w oparciu o opisowe wytyczne zawarte w normie PN-EN ISO 10993-5. Biologiczna reaktywność komórek oceniania jest w skali od stopnia 0 (brak reaktywności) do stopnia 4 (wysoka reaktywność); przyjmuje się, że wyrób medyczny jest niecytotoksyczny, jeśli żadna z kultur wystawionych na działanie materiału badanego nie wykazuje poziomu wyższego niż stopień 2 (łagodna reaktywność).
Odczyt wpływu cytotoksycznego materiału badanego na komórki wykonywany jest z wykorzystaniem mikroskopu fluorescencyjnego, dzięki któremu możliwym jest zobrazowanie stanu komórek bezpośrednio przed i po usunięciu badanego materiału, w oparciu o opisowe wytyczne zawarte w normie PN-EN ISO 10993-5. Biologiczna reaktywność komórek oceniania jest w skali od stopnia 0 (brak reaktywności) do stopnia 4 (wysoka reaktywność); przyjmuje się, że wyrób medyczny jest niecytotoksyczny, jeśli żadna z kultur wystawionych na działanie materiału badanego nie wykazuje poziomu wyższego niż stopień 2 (łagodna reaktywność).
Dobór odpowiedniej metody badania cytotoksyczności biomateriałów czy wyrobów medycznych uzależniony jest od rodzaju/ rodzajów wykorzystywanych do produkcji biomateriałów, kształtu czy docelowego zastosowania wyrobu medycznego. Zapraszamy do kontaktu z Naszymi specjalistami w celu wybrania odpowiedniej metody badawczej, zgodnie z Państwa potrzebami.
Laboratoria Śląskiego Parku Technologii Medycznych Kardio-Med Silesia objęte są certyfikatem zgodności z zasadami Dobrej Praktyki Laboratoryjnej dla badań biokompatybilności (tj. zakresem nr 9, definiowanym Rozporządzeniem Ministra Zdrowia z dnia 3 sierpnia 2021 r. w sprawie Dobrej Praktyki Laboratoryjnej i wykonywania badań zgodnie z zasadami Dobrej Praktyki Laboratoryjnej), m.in. badań cytotoksyczności in vitro.













