Jednostka Badawcza DPL – Badania in vivo
Badania in vivo odgrywają kluczową rolę w procesie oceny bezpieczeństwa, skuteczności i działania wyrobów medycznych przed ich wprowadzeniem na rynek. Termin „in vivo” odnosi się do eksperymentów przeprowadzanych w organizmach żywych, takich jak zwierzęta laboratoryjne lub ludzie, w przeciwieństwie do badań „in vitro„, które odbywają się poza organizmem.
Jednym z głównych założeń prowadzenia badań in vivo w naszym ośrodku jest zachowanie zasad Dobrych Praktyk Laboratoryjnych (GLP), które gwarantują dokładność, powtarzalność i wiarygodność wyników. Dzięki GLP, badania in vivo są planowane, przeprowadzane i dokumentowane w ściśle określony sposób, co umożliwia rzetelną ocenę wpływu wyrobów medycznych na organizmy żywe.
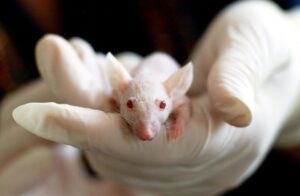 W badaniach in vivo stosuje się różne modele zwierząt, w zależności od celu badania i specyfiki produktu. Modele małych zwierząt, takie jak myszy lub szczury, często używane są do początkowych badań toksyczności i skuteczności. Modele dużych zwierząt, jak np. świnia domowa, są bardziej zbliżone do organizmu ludzkiego pod względem anatomii i fizjologii, co pozwala na bardziej wiarygodne prognozowanie działania wyrobów medycznych u ludzi.
W badaniach in vivo stosuje się różne modele zwierząt, w zależności od celu badania i specyfiki produktu. Modele małych zwierząt, takie jak myszy lub szczury, często używane są do początkowych badań toksyczności i skuteczności. Modele dużych zwierząt, jak np. świnia domowa, są bardziej zbliżone do organizmu ludzkiego pod względem anatomii i fizjologii, co pozwala na bardziej wiarygodne prognozowanie działania wyrobów medycznych u ludzi.
Badania in vivo pozwalają na ocenę wpływu produktów medycznych na cały organizm, w tym na układy narządowe i procesy biologiczne. Mogą być wykorzystywane do identyfikacji potencjalnych działań niepożądanych, oceny biodostępności substancji czynnych oraz monitorowania długoterminowych efektów terapeutycznych.
 Podsumowując, badania in vivo są niezastąpionym etapem w procesie oceny wyrobów medycznych, zapewniając rzetelne i kompleksowe informacje na temat ich wpływu na organizmy żywe. Dzięki zastosowaniu modeli małych i dużych zwierząt oraz przestrzeganiu zasad GLP, możliwe jest lepsze zrozumienie skutków stosowania wyrobów medycznych i zapewnienie ich bezpieczeństwa oraz skuteczności przed dostępem do pacjentów.
Podsumowując, badania in vivo są niezastąpionym etapem w procesie oceny wyrobów medycznych, zapewniając rzetelne i kompleksowe informacje na temat ich wpływu na organizmy żywe. Dzięki zastosowaniu modeli małych i dużych zwierząt oraz przestrzeganiu zasad GLP, możliwe jest lepsze zrozumienie skutków stosowania wyrobów medycznych i zapewnienie ich bezpieczeństwa oraz skuteczności przed dostępem do pacjentów.
Śląski Park Technologii Medycznych Kardio-Med. Silesia w Zabrzu posiada certyfikat Dobrej Praktyki Laboratoryjnej w części biokompatybilność (zakres 9) dla biologicznej oceny wyrobów medycznych dla badań m.in. in vivo.
Zapraszamy do kontaktu, w celu dopasowania odpowiedniej metody badawczej do Państwa wyrobu medycznego.












